Ein Primärantikörper bindet sich direkt an spezifische Antigene mit hoher Spezifität und Affinität, um die Antigene zu reinigen oder nachzuweisen und zu messen. Primäre Antikörper können entweder als monoklonale Antikörper entwickelt werden, die sich an ein bestimmtes Epitop auf dem Antigen binden, oder als polyklonale Antikörper, die sich an mehrere verschiedene Epitope auf dem Antigen binden, wobei Tiere als Wirte verwendet werden. Normalerweise sind das Ratten, Kaninchen, Mäuse, Ziegen und andere Tierarten.
Primärantikörper können gegen jedes Antigen von Forschungsinteresse erzeugt werden, einschließlich: Proteine, Peptide, Kohlenhydrate und andere kleine Moleküle. Es können auch Primärantikörper erzeugt werden, um posttranslationale Modifikationen wie Phosphorylierung, Acetylierung, Methylierung und Glykosylierung zu erkennen. Primärantikörper eignen sich daher hervorragend zur Analyse von Bestandteilen lebender Zellen auf molekularer Ebene und zur Identifizierung von Proteinen, die an Krankheiten beteiligt sein oder diese verursachen können.
Wir haben über 65.000 unkonjugierte und direkt konjugierte Primärantikörper gegen mehr als 14.000 Targets im Angebot. Alle Antikörper werden in mehrfachen Forschungsanwendungen und mit Stichproben von mehreren Spezies, validiert. Eine wachsende Anzahl von Antikörpern wurde ebenfalls einer Knockout-Validierung unterzogen, um deren Spezifität sicherzustellen.
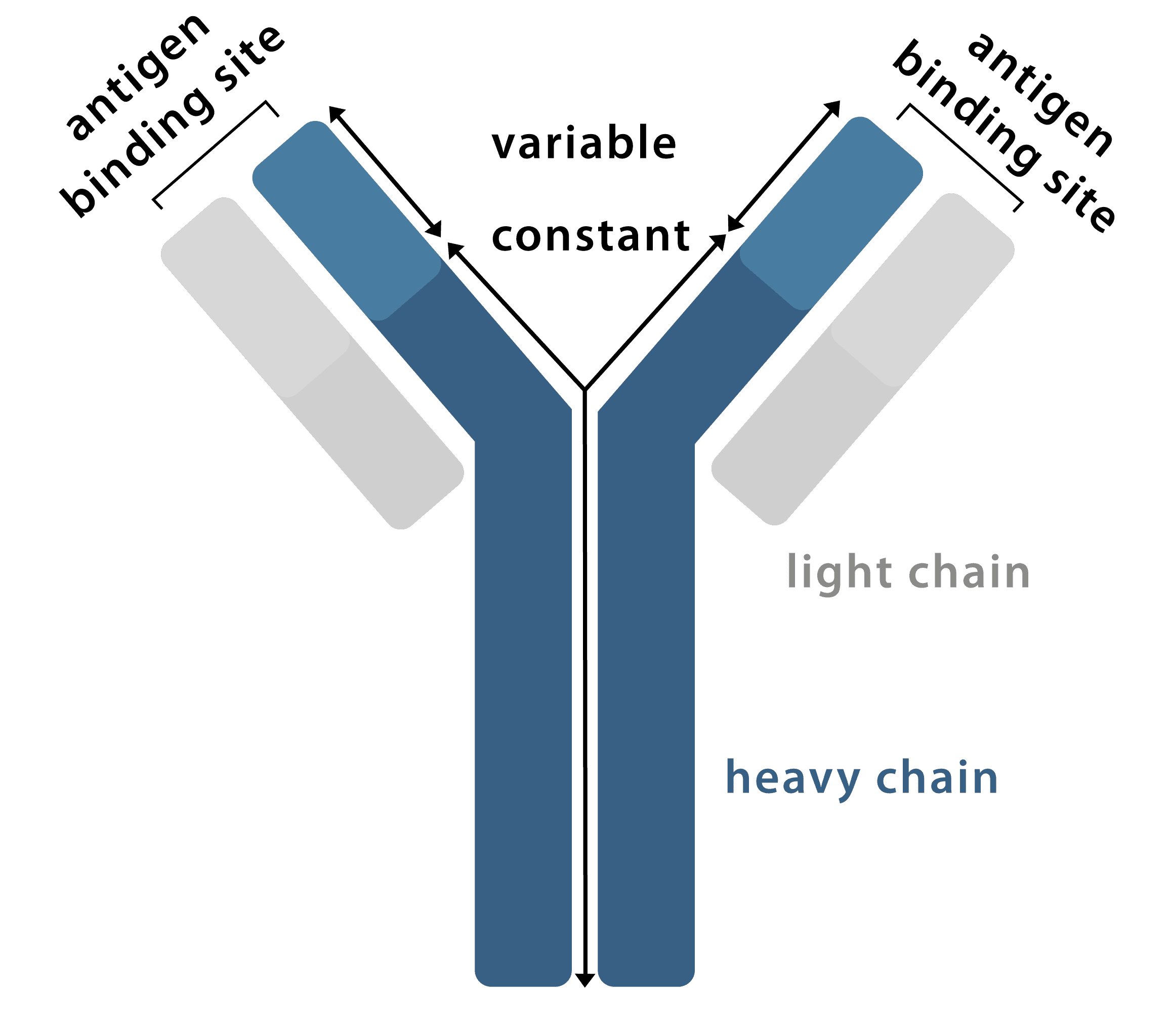
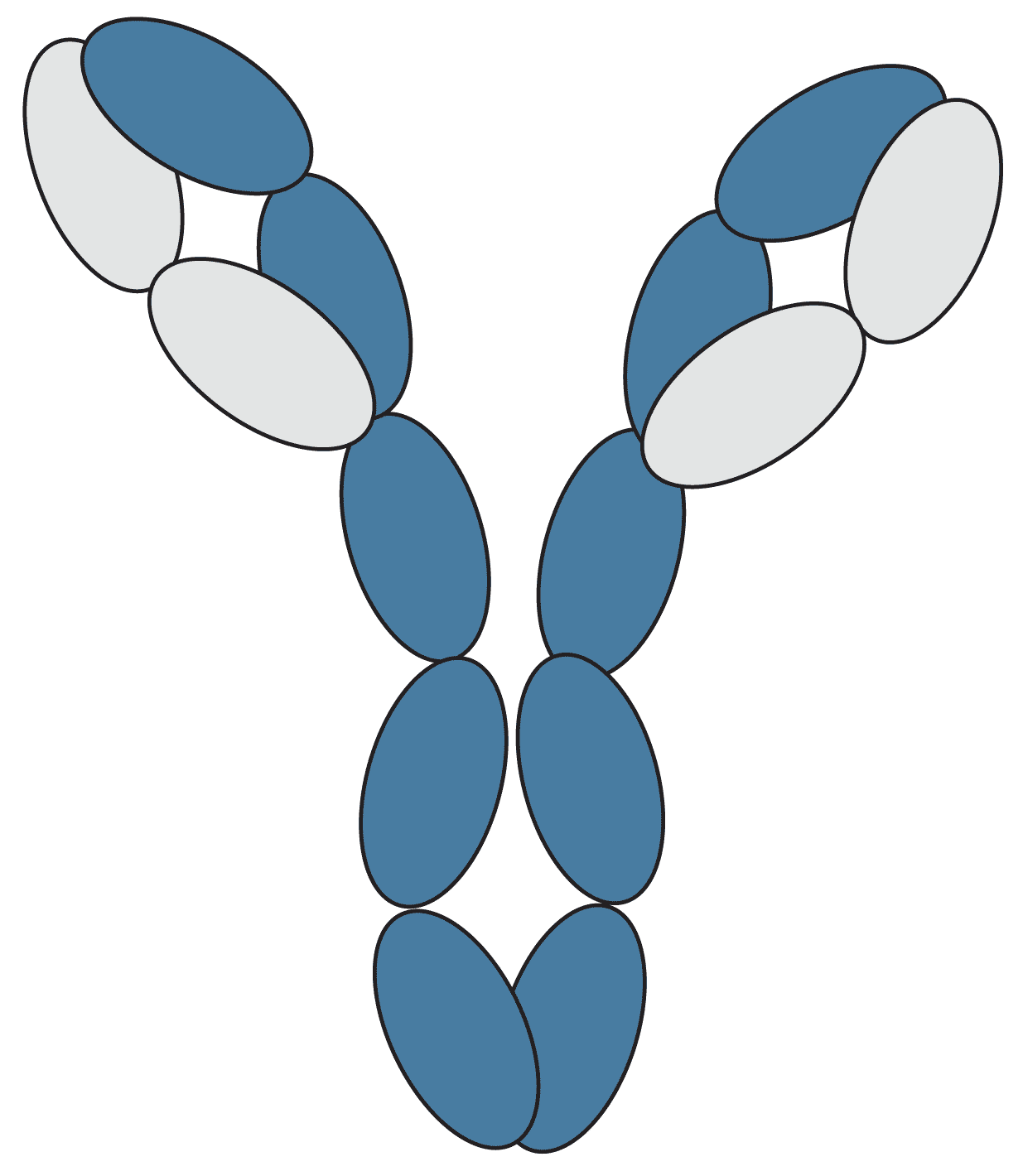
Ein Antikörper ist ein Y-förmiges Glykoprotein, das vom körpereigenen Immunsystem als Reaktion auf die Invasion fremder Moleküle produziert wird und an bestimmte Antigene binden kann. Jeder Antikörper besteht aus vier Polypeptidketten, zwei identischen schweren Ketten und zwei identischen leichten Ketten, die sich in Sequenz und Länge unterscheiden. Ein Antikörper kann unterteilt werden in: zwei F (ab) -Regionen, die oberen Abschnitte des l'Y', die die variable Region enthalten, die spezifisch an ein bestimmtes Epitop auf dem Antigen bindet, und eine Fc-Region, den Boden des 'Y', die eine Bindungsstelle für endogene Fc-Rezeptoren (und sekundäre Antikörper) bereitstellt.
Abbildung 1: Grafische Darstellung eines Antikörpers.
Monoklonale Antikörper werden hergestellt, indem ein Antigen in ein Wirtstier injiziert wird, um eine humorale Immunantwort auszulösen, und anschließend die Antikörper produzierenden Milzzellen extrahiert und in vitro mit kultivierten malignen Myelomzellen fusioniert werden, um unsterbliche Hybridomzelllinien zu erzeugen. Dies stellt eine stabile, langfristige Versorgung mit monoklonalen Antikörpern bereit. Monoklonale Antikörper sind identisch, erkennen ein einzelnes Epitop und stammen aus einer Gruppe identischer klonierter Zellen. Jedem Klon von Hybridomzellen wird eine Klon-ID gegeben, die den von ihm produzierten monoklonalen Antikörper identifiziert.
Polyklonale Antikörper werden durch Injektion eines Antigens in ein Wirtstier hergestellt, um eine humorale Immunantwort auszulösen. Nach der anfänglichen Immunisierung erhält das Wirtstier eine sekundäre und möglicherweise eine tertiäre Immunisierung, um höhere Konzentrationen an Antikörpern gegen das bestimmte Antigen zu erzeugen. Polyklonale Antikörper sind eine Sammlung mehrerer verschiedener Antikörper, die aus der Immunantwort mehrerer B-Zellen stammen und jeweils ein anderes Epitop auf demselben Antigen erkennen.
Monoklonal vs Polyklonal Antikörper
| Polyklonal | Monoklonal |
|---|---|
| Eine heterogene Antikörperpopulation. | Eine homogene Antikörperpopulation. |
| Fehlende Epitopspezifität; bindet an mehrere verschiedene Epitope eines Antigens. | Hohe Spezifität und Affinität für ein einzelnes Epitop auf einem einzelnen Antigen. |
| Erhöhte Wahrscheinlichkeit einer Kreuzreaktivität mit ähnlichen Antigenen. | Geringeres Risiko einer Kreuzreaktivität (aufgrund der Spezifität für ein einzelnes Epitop). |
| Hohe Variabilität von Charge zu Charge. | Keine / geringe Variabilität von Charge zu Charge. |
| Kann in einigen Anwendungen Hintergrundgeräusche verursachen. | Erzeugen Sie weniger Hintergrundgeräusche durch Färben von Abschnitten / Zellen. |
| Relativ kostengünstig herzustellen. | Deutlich teurer in der Herstellung. |
| Relativ schnell zu produzieren (~ 3 Monate). | Langsam zu produzieren (~ 6 Monate). |
Bei Säugetieren werden Antikörper entsprechend der darin enthaltenen schweren Kette in fünf Hauptklassen oder Isotypen eingeteilt. Dies sind: IgA (alpha), IgD (delta), IgE (epsilon), IgG (gamma) und IgM (mu). Jede Klasse unterscheidet sich in der Reihenfolge der konstanten Domänen, der Anzahl der konstanten Domänen, der Gelenkstruktur und der Wertigkeit des Antikörpers.
Die leichten Ketten eines Antikörpers werden basierend auf ihrer Polypeptidsequenz entweder als Kappa oder Lambda klassifiziert. Typischerweise ist in einem einzelnen Antikörper nur ein Typ einer leichten Kette vorhanden, und als solcher sind die beiden vorhandenen leichten Ketten identisch.
| Isotyp | Schwere Kette | Lichterkette | Struktur |
|---|---|---|---|
| IgG1 | γ1 | λ oder κ | Monomer |
| IgG2a | γ2 | λ oder κ | Monomer |
| IgG2b | γ2 | λ oder κ | Monomer |
| IgG3 | γ3 | λ oder κ | Monomer |
| IgG4 | γ4 | λ oder κ | Monomer |
| IgA1 | α1 | λ oder κ | Monomer oder dimer |
| IgA2 | α2 | λ oder κ | Monomer oder dimer |
| IgD | δ | λ oder κ | Monomer |
| IgE | ε | λ oder κ | Monomer |
| IgM | μ | λ oder κ | Pentamer |
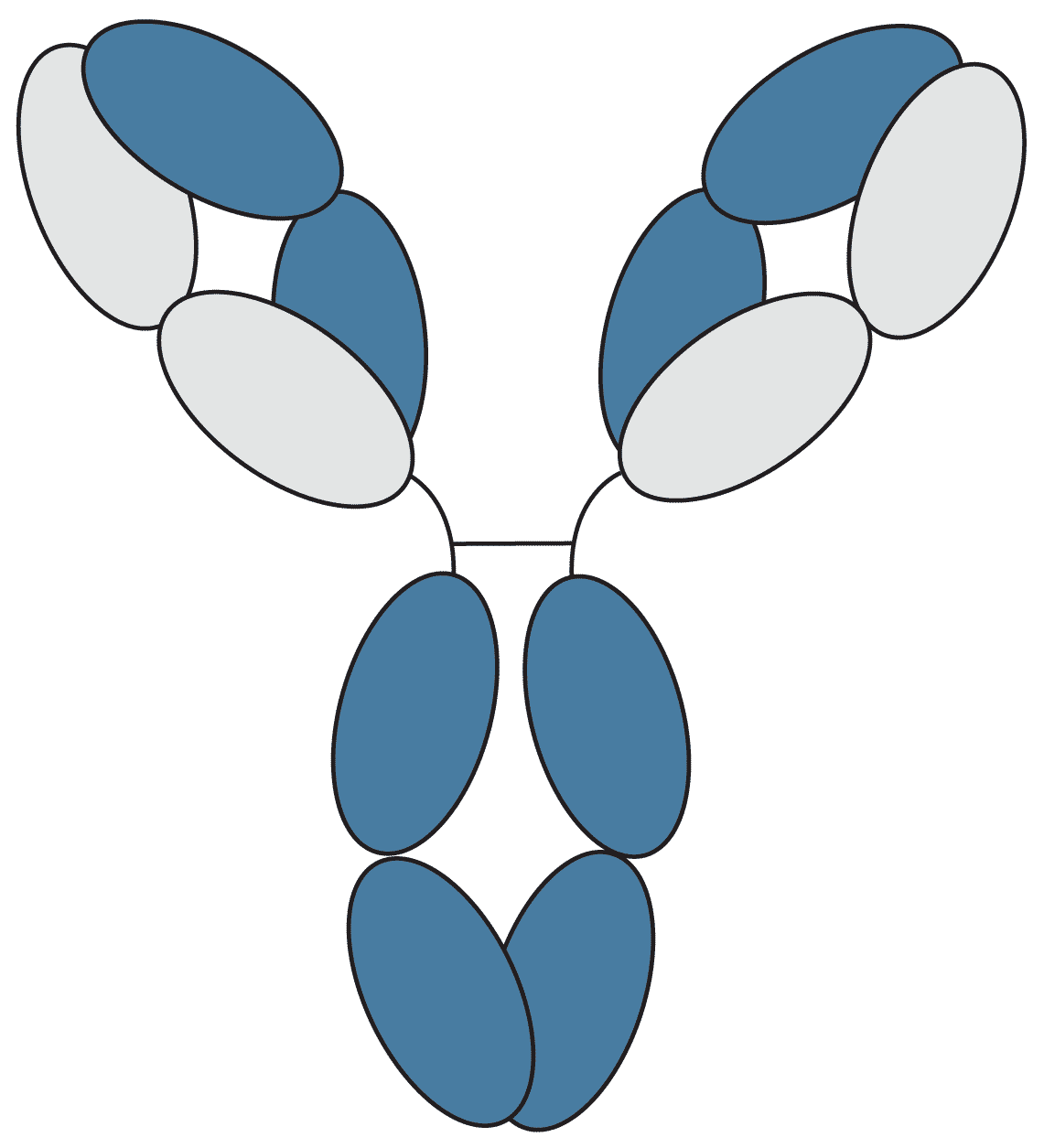
IgG (bestehend aus IgG1, IgG2a, IgG2b, IgG3 und IgG4) ist der am häufigsten vorkommende Antikörper im normalen Humanserum und macht 70-85% des gesamten Immunglobulinpools aus. IgG ist am Plazentatransfer beteiligt, wobei das IgG der Mutter auf den Fötus übertragen wird, um in den ersten Entwicklungsstadien einen Immunschutz zu gewährleisten.
Abbildung 2: Grafische Darstellung von IgG.
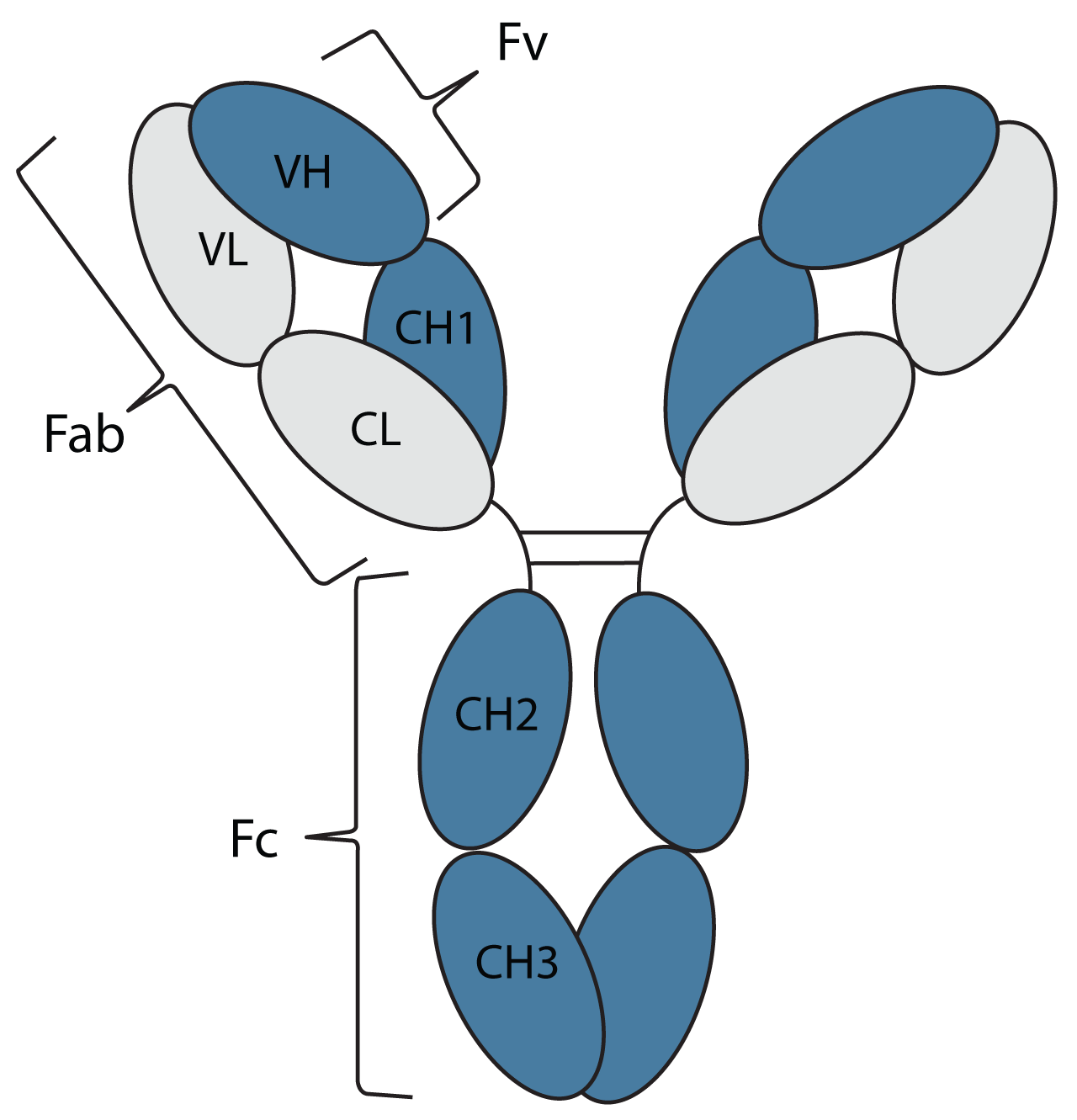
Jedes Oval repräsentiert eine Proteindomäne im Antikörper. Diese werden systematisch nach ihrem Kettentyp (L = leichte Kette oder H = schwere Kette) markiert und danach, ob sich ihre Sequenz ändert, um ein Antigen zu binden (V = variable Domäne oder C = konstante Domäne), wobei CH-Domänen aus der variablen Region nummeriert sind. Die Domänen sind durch Linkerregionen von Protein- und Disulfidbindungen verbunden, die durch Linien dargestellt werden.
Die Struktur des Antikörpers wird auch in Bezug auf die Fragmente beschrieben, die durch Proteinabbau oder enzymatische Spaltung von Linkerregionen hergestellt wurden, nämlich die Antigen-bindenden Fragmente (Fab), die variablen Fragmente (Fv) und das konstante Fragment (Fc).
IgA (bestehend aus IgA1 und IgA2) macht etwa 5-15% des Antikörperpools aus und liegt entweder als Monomer oder als Dimer vor. IgA ist der vorherrschende Antikörper in Schleimsekreten wie Speichel, Tränen und Milch.
Abbildung 3: Graphische Darstellung von IgA.
IgD macht nur ungefähr 1% des gesamten Plasma-Immunglobulins aus, wird jedoch in großen Mengen auf der Membran von B-Zellen gefunden. IgD hat die gleiche Grundstruktur wie IgG, jedoch eine erweiterte Gelenkregion, die für eine proteolytische Verdauung anfällig ist. Es wird angenommen, dass IgD als Antigenrezeptor für die Aktivierung von B-Zellen dient.
Abbildung 4: Grafische Darstellung von IgD.
IgE macht nur ungefähr 0,002% der Serumantikörper aus und wird auf den Basophilen und Mastzellen gefunden. Ähnlich wie IgM hat IgE zwei zusätzliche konstante Domänen anstelle einer Gelenkregion. IgE ist vermutlich eine Rolle bei der Immunität gegen Parasiten spielen, aber mehr ist häufig mit Typ-I-Überempfindlichkeits sofort verbunden ist, zu unschädlichen Umweltantigenen wie Pollen reagiert und Erdnüsse, die in extremen Reaktionen wie Anaphylaxie oder allergische Rhinokonjunktivitis zur Folge haben können.
Abbildung 5: Graphische Darstellung von IgE.
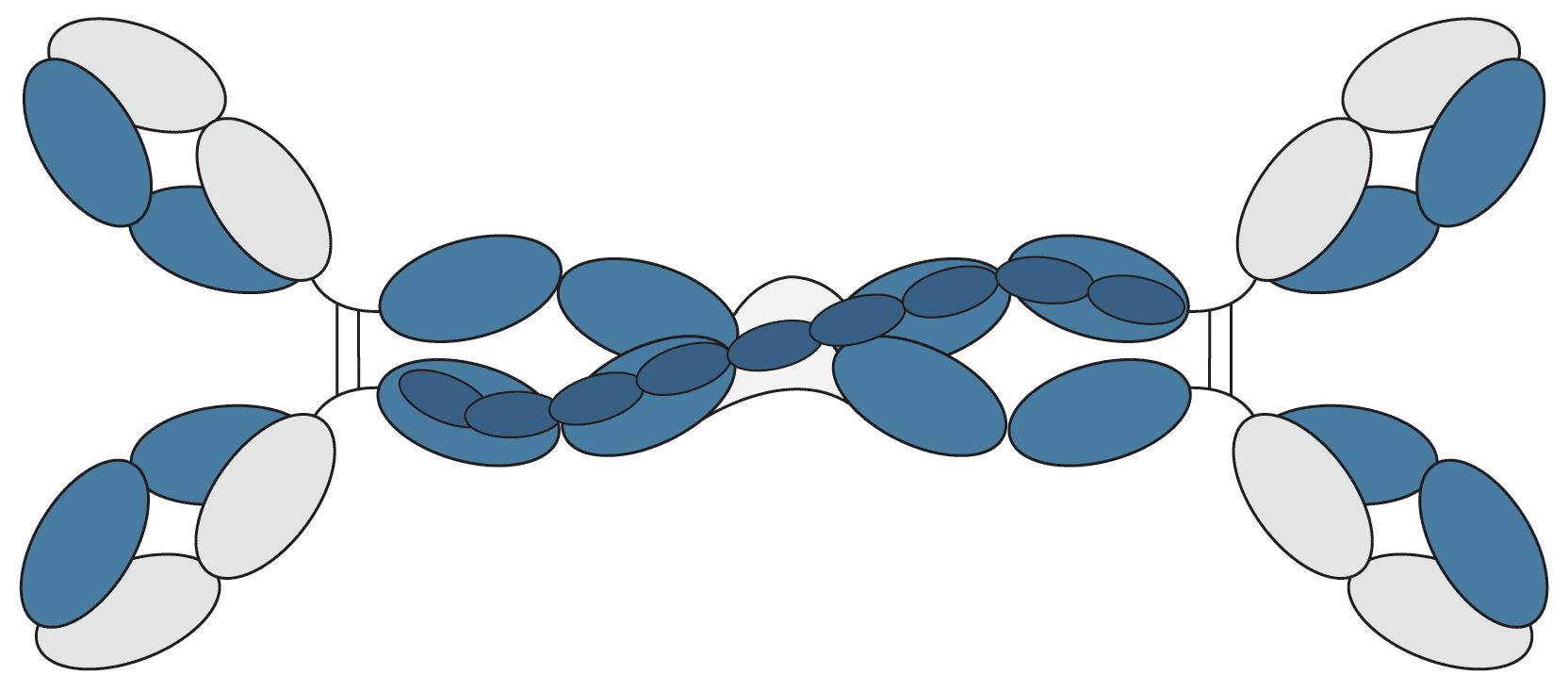
IgM macht zwischen 5 und 10% der Immunglobulinpopulation aus und ist der vorherrschende Antikörper in der primären Immunantwort des Körpers. Es wird oft als Pentamer mit einer fünfkettigen Struktur dargestellt, die durch eine J-Kette zusammengehalten wird. Es kann jedoch auch in hexamerer Form ohne die J-Kette und als Monomer auf der Oberfläche von B-Zellen vorliegen. Die große Größe an löslichem IgM (~ 900 kDa) beschränkt diesen Antikörper hauptsächlich auf den intravaskulären Pool.
Abbildung 6: Graphische Darstellung der IgM.
Jede Klonnummer repräsentiert eine spezifische Zelllinie, die aus Aszites kloniert wurde und zur Herstellung des Antikörpers verwendet wurde. Da Antikörper von mehr als einem Wirt produziert werden, erhält jede klonierte Zelllinie eine eindeutige Klonnummer, um sie zu identifizieren.
Sekundärantikörper sollten gegen die Wirtsspezies des von Ihnen verwendeten Primärantikörpers erzeugt werden. Wenn Ihr primärer Antikörper beispielsweise ein monoklonaler Rattenantikörper ist, benötigen Sie einen sekundären Anti-Ratten-Antikörper. Wir empfehlen, das Datenblatt des sekundären Antikörpers zu überprüfen, um sicherzustellen, dass er in der von Ihnen verwendeten Anwendung validiert wurde.
Isotypkontrollen werden verwendet, um zu bestätigen, dass die Bindung des primären Antikörpers spezifisch ist und nicht ein Ergebnis anderer Proteininteraktionen oder einer unspezifischen Fc-Rezeptorbindung ist.
Der Isotyp-Kontrollantikörper sollte mit den Wirtsspezies, dem Isotyp und der Konjugation der Primärantikörper übereinstimmen. Wenn der primäre Antikörper beispielsweise ein HRP-konjugiertes Ratten-IgG1 ist, benötigen Sie eine HRP-konjugierte Ratten-IgG1-Isotypkontrolle.
Wir empfehlen, zuerst das Datenblatt zu überprüfen, da häufig eine positive Kontrolle vorgeschlagen wird. Es ist wichtig sicherzustellen, dass das verwendete Gewebe oder die verwendete Zelllinie von einer getesteten Spezies stammt.
Wenn keine positiven Kontrollen vorgeschlagen werden, empfehlen wir, die UniProt-Website zu besuchen. Diese Datenbank enthält häufig eine Liste von Geweben, in denen das Protein exprimiert wird. Diese Gewebe können als geeignete Positivkontrollen angesehen werden.
Viele unserer Antikörper haben Verdünnungsanweisungen auf ihren Datenblättern. In diesen Fällen empfehlen wir, diese Anweisungen zu befolgen. Für Antikörper ohne empfohlene Verdünnungen empfehlen wir die Verwendung der folgenden Tabelle, um eine Anfangsverdünnung zu bestimmen.
| Anwendung | Tissue Culture Serum | Aszites | Ganzes Antiserum | Gereinigter Antikörper |
|---|---|---|---|---|
| WB / DB | 1/100 | 1/1,000 | 1/500 | 1 µg/ml |
| FC | 1/100 | 1/1,000 | 1/500 | 1 µg/ml |
| ELISA | 1/1,000 | 1/10,000 | 1/500 | 0.1 µg/ml |
| IHC / ICC | Neat - 1/10 | 1/100 | 1/50 - 1/100 | 5 µg/ml |
| IP | --- | 1/100 | 1/50 - 1/100 | 1-10 µg/ml |
Die meisten ungereinigten Antikörper (d. H. Ganzes Antiserum, Kulturüberstand oder Aszitesflüssigkeit) haben keine auf ihren Datenblättern angegebene Konzentration, da sie nicht bestimmt wurden. Diese Antikörper können in spezifischen Antikörperkonzentrationen signifikant variieren. Als grobe Konzentrationsschätzung: Gewebekulturüberstände sind 1-3 mg / ml, Aszites sind 5-10 mg / ml und ganze Antiseren sind 1-10 mg / ml.
Es ist wichtig zu beachten, dass die Verdünnungen / Konzentrationen in der obigen Tabelle lediglich als Ausgangspunkt empfohlen werden. Es kann erforderlich sein, die Verdünnung / Konzentration basierend auf experimentellen Ergebnissen anzupassen.
Wir empfehlen, den Antikörper immer wie im Datenblatt angegeben aufzubewahren. Wir können nicht garantieren, wie sich der Antikörper verhält, wenn er unter anderen Bedingungen gelagert wird.
Die Größe der Aliquots hängt davon ab, wie viel man normalerweise in einem Experiment verwendet. Die Aliquots sollten nicht kleiner als 10 µl sein. Je kleiner das Aliquot ist, desto stärker wird die Konzentration durch Verdampfung und Adsorption des Antikörpers auf der Oberfläche des Fläschchens beeinflusst.